Todos los dias somos impactados por miles de anuncios en forma de banners, links, mails donde las compañías se intentan hacer oír entre el ruido de la publicidad y propaganda feroz propia de nuestra sociedad consumista.
Tanto es así que en un día recibimos tantos impactos visuales como recibiría un hombre de la edad media a lo largo de toda la vida. Tanto es así que hemos desarrollado una coraza anti-spam que hace complicada la vida a las empresas de publicidad y marketing.
Al final da igual si usas un Samsung Galaxy o un iPhone ya que lo usamos siempre para lo mismo: llamar, enviar mensajes, redes sociales, Mail, Tinder y en el caso del Samsung incluso como artefacto explosivo.
En odontología nos pasa lo mismo; las casas comerciales intentan diferenciarse anunciando productos innovadores, mejoras en su antiguo portfolio o incluso vendiendo algo que aún no han desarrollado.
Felizmente contamos con las publicaciones científicas, donde a pesar del sesgo, si siguen existiendo investigaciones y publicaciones- por fortuna independientes y honestas- que nos indican qué productos si deberíamos considerar en nuestra práctica clínica diaria.
Uno de los temas “calientes” en implantología es el tema de las superficies, donde a menudo escuchamos el famoso mantra de “todas las superficies son iguales” o “la mejor superficie es la mecanizada” o incluso últimamente estamos viendo publicaciones sobre auto-transplantes de dientes del propio paciente para reponer una ausencia, con unos resultados prometedores.
En este campo destacar el trabajo de Ernest Lucas con resultados verdaderamente sorprendentes. Os recomiendo sin dudarlo que asistáis a una de sus ponencias que seguramente no os dejará indiferentes.
Pero volvamos al tema de las superficies:
¿Son realmente todas iguales?
¿Qué diferencias aportan las superficies desde un punto de vista clínico?
¿Qué tipos de superficies de implantes existen y cuales deberíamos usar?
En este artículo intentaré poner de relieve algunos puntos claves sobre el estado del arte de superficies de implantes que actualmente existen el mercado.
#1. Clasificación de las superficies
Esta clasificación divide los implantes según los valores de rugosidad de su topografía. Estas mediciones pueden ser basadas en dos parámetros:
– Ra- medición en 2 dimensiones
– Sa- Medición en 3 dimensiones.
En este artículo nos centraremos en el valor Sa que es más relevante que el valor Ra.
Según la clasificación de Ann Wenneberg & Albrektsson (2004), las superficies se dividen en:
– Sa 0.5 µm- Superficies
– Sa 0.5–1 µm- Superficies
– Sa 1–2 µm- Superficies moderadamente rugosas.
– Sa >2µm- Superficies muy rugosas.
A distinto valor Sa, diferente comportamiento biológico.
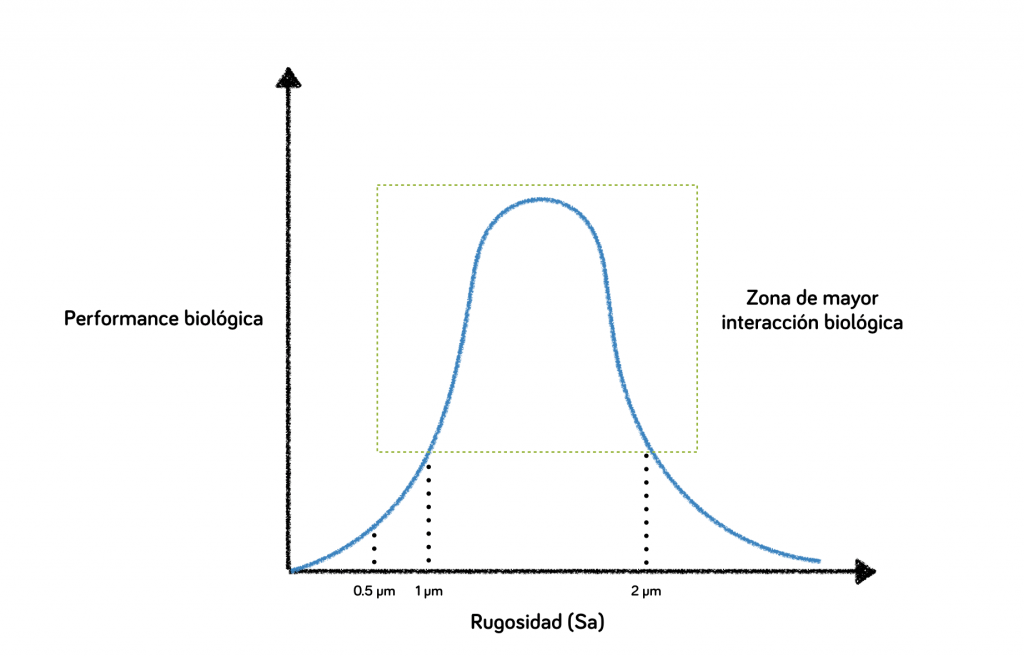
De las técnicas más usadas para realizar cambios en las superficies de los implantes, existen dos tipos:
1. Técnicas substractivas
2. Técnicas aditivas.
#1. Técnicas substractivas
Superficies chorreadas
Estas superficies consiguen un óptimo BIC (Bone-Implant-Contact) y un torque de remoción mas alto que las superficies mecanizadas.
El valor Sa alcanzado en este tipo de superficies ronda el 1.5µm encuadrándola dentro de las superficies moderadamente rugosas (Wenneberg 1998).
Existen varias publicaciones en animales comparando estas superficies chorreadas con las superficies mecanizadas y en todos los estudios el BIC y el torque de remoción del implante chorreado es más alto que las superficies mecanizadas.
Por otro lado los estudios clínicos no han podido probar esta superioridad de los implantes chorreados (Karlsson 1998).
Hay que mencionar la dificultad en convencer a los apacientes a que se le remueva un implante a contra-torque, de ahí la dificultad en las comparación a nivel clínico.
En este video se puede ver un proceso de arenado de la superficie.
Ataque ácido.
En este grupo es donde vamos a encontrar que mayor rugosidad, o lo que es lo mismo, mayor valor Sa, no significa mejor interacción biológica.
Para prueba de ellos, el estudio de Cordiolli (2000) donde comparó el torque de remoción de implantes con distinto Sa:
– Superficie mecanizada con un valor Sa de 0.29 µm
– Superficie grabada con ataque ácido con un valor Sa de 0.62 µm
– Superficie chorreada con u valor Sa de 1.26 µm
– Superficies TPS (técnica aditiva) con un valor Sa 9.10 µm
Y efectivamente el implante que obtuvo mayor torque de remoción fue el de superficie tratada con ataque ácido con solo 0,62 µm de valor de Sa.
Existen muchos otros estudios con la misma conclusión; una mayor rugosidad no implica un mayor BIC (Bone Implant Contact).
Si profundizamos en los ensayos clínicos existen otros puntos que son importantes de resaltar:
– Hay una presencia de patógenos periodontales, independientemente de la superficie del implante (Shibli 2007).
– La tasa de éxito de los implantes con doble ataque ácido es superior a la tasa de éxito de las superficies mecanizadas pero sin diferencias significativas (Khang 2001).
– Los implantes con tratamiento de ataque ácido tienen una mejor Osteointegración que los implantes mecanizados, aunque clínicamente sea difícil de probar debido a la no coveniencia de realizar histologías de implantes colocados en pacientes y la realización de la remoción de los implantes a contra-torque para verificar su resistencia al contra-torque.
#3. Supericies con ataque ácido + chorreado
Este tipo de superficie e s la más investigada y la más usada en la implantología actual.
Todos hemos escuchado hablar de la superficie SLA (Sandblasted, Large-Grit, Acid-Etched) y todos hemos recibido en nuestras clínicas asesores comerciales con un “novedoso” implante que tiene “exactamente la misma superficie SLA de Straumann”, y que esa superficie SLA ha sido desarrollada por un ingeniero fugado de Straumann.
La historia se repite una y otra vez ya que a nivel de evidencia científica, la superficie de Straumann ha demostrado ser la más avalada y la que tiene mejores resultados a largo plazo (Derks 2014) según un estudio a largo plazo realizado en la población sueca tal como resume esta infografía.
He llegado a pensar que en Straumann deben de haber implementado unas medidas de seguridad como en el pentágono para evitar que sus ingenieros sigan “fugandose” para acabar desarrollando la “misma” superficie en alguna otra compañía.
Por eso siempre debemos preguntar al asesore comercial que nos presenta el “novedoso implante” que valor Sa tiene el tal disruptivo implante.
Si la respuesta es “no lo sé” o simplemente “no tenemos ese dato”, entonces es porque no deberíamos usar ese implante en nuestros pacientes ya que no presenta los requisitos ni la investigación mínima como para ser tratado como un Medical Device seguro.
También se ha investigado la influencia la superficie SLA en las células mesenquimales y se ha constatado que este tipo de superficies promueven la diferenciación de las células madre.
Esto implica que las superficies SLA son más osteoconductoras comparadas con las superficies mecanizadas y consiguen una mayor integración entre el hueso y el implante. El resultado es una valor BIC (Bone Implant Contact) superior y unos torques de remoción del implante también superiores (Davies 2003).
Desde un punto de vista clínico la superficie SLA aporta unas ventajas notables comparadas con otras superficies, reduciendo el tiempo de osteointegración y pueden ser cargados a las 6-8 semanas.
Reduciendo los tiempos de integración se reduce también el riesgo de que el implante puedan ser sometido a micro-movimientos que podrían provocar la fibrointegración del implante (Szmukler-Moncler 1998).
En el mercado existen varias superficies con los valores Sa oficiales que deberíamos conocer (Rodriguez Rius 2005, Dohan Ehrenfest 2011).
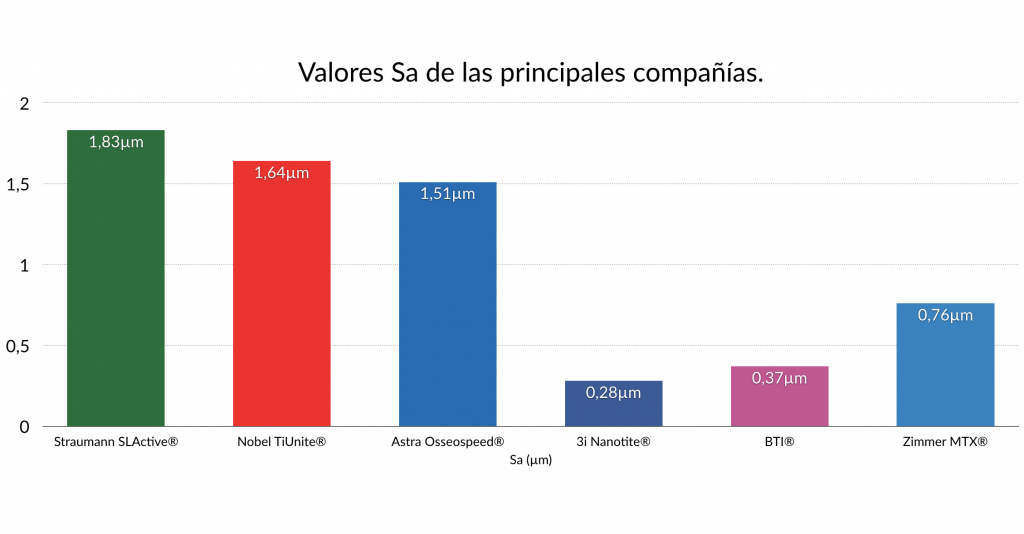
Dentro de las superficies, la más conocida y avalada científicamente es la superficie SLA de Straumann® con un valor Sa de 1,83µm.
Superficies hidrofílicas. Un punto y aparte.
Dentro de las superficies SLA se merece una especial mención las superficies hidrofílicas, donde en el mercado la más famosa es la superficie SLActive®.
Esta superficie mejora la adhesión inicial de las proteínas necesarias para el inicio de la cicatrización ósea y del proceso de osteointegración (Schwarz 2007,2008, Lang 2011).
Se puede observar el potencial diferenciador de esta superficie mediante la medición del ISQ con un Osstell®. Normalmente a partir de la tercera semana después de la colocación del implante ya se observa un valor ISQ (>70) adecuado para la carga temprana (Bornsteim 2010).
Estas superficies han demostrado tener un comportamiento superior en casos de pacientes diabéticos, maxilar posterior donde la densidad ósea es baja y pacientes diabéticos (Nicolau 2013, Nicolau 2016, Nelson 2016, Cabrera-Domínguez 2017).
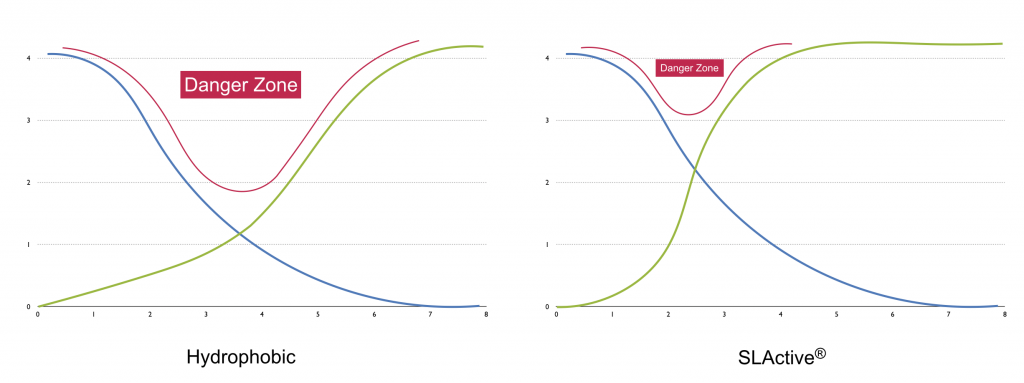
Al reducir el tiempo de osteintegración, se reduce también la “danger zone” asi denominada por Anne Wenneberg en su libro “Implant Surfaces and their Biological and Clinical Impact”.
Esta reduccíon de la “zona de peligro es especialmente útil en casos de carga inmediata donde el paciente puede someter el implante a micromovimientos durante esta fase, provocando su fibrointegración (Szmukler-Moncler 1998).
#3. Oxidación
Todos los implantes contienen una capa de óxido nativa en su superficie que puede ser inducido por un tratamiento térmico o bien colocando el implante en una celda galvánica para incrementar la superficie nativa de óxido.
Esta capa oxidada de la superficie varia en grosor de 1,17µm a 1,35µm (Ivanoff 2003, Sul 2006).
Los estudios comparativos existentes con superficies oxidadas reportan una mayor tasa der éxito en carga inmediata comparados con implantes de superficie mecanizada (Rocci 2003).
Cabe destacar que en este estudios los implantes utilizados tenia la mimas macro-geometría.
Aunque la palabra “oxidación” pueda parecer poco “amigable” sobretodo para un dispositivo que va a ser implantado en pacientes humanos, una de las superficies más usadas en el mercado se basa en esta tecnología, la TiUnite®.
Técnicas Aditivas
#1. TPS
Dentro de las superficies resultantes por técnicas aditivas, la más famosas son las superficies TPS.
Consiste en la aplicación de partículas de titanio sobre la superficie del implante mediante un spray de plasma.
Este proceso crea una superficie extremadamente rugosa – 4 a 5 µm (Wenneberg 2009).
Si la una mayor rugosidad de la superficie significará una mayor interacción biológica, sin duda la superficie TPS sería el Gold Standard de las superficies.
Pero no es así y se ha probado que:
– Tienen mayor perdida de hueso marginal (Becker 2000).
– Mayor tasa de fracaso, especialmente en pacientes con antecedentes de enfermedad periodontal y pacientes fumadores (De Boever 2009).
#2. Superficies revestidas de hidroxiapatita y os fosfato de calcio
Al igual que las superficies TPS, estas superficies son altamente rugosas.
A corto plazo se han demostrado biocativas y promueven la osteogenesis.
Se les ha asociado como la actividad de células gigantes multinucleares cuya actividad en la proximidad de los implantes promueve la reabsorción ósea.
No son recomendables.
Conclusiones
Una vez analizados los varios tipos de superficies podemos concluir que:
– Casi todas las casas comerciales tienen sus sistemas de implantes con superficies con un. Valor Sa entre 1-2 µm (superficies moderadamente rugosas). Una casa comercial que no ha realizado una investigación seria sobre las características de la superficie de su sistema, debería ser cuestionada su fiabilidad.
– La carga temprana debe ser validad y avalada por publicaciones científicas realizadas con el sistema de implantes de cada casa comercial. No se pueden extrapolar la validez de una técnica en concreto únicamente porque la superficie “es similar a x”.
– La macro-geometría del implante puede tener un impacto directo en el periodo de cicatrización. OJO- Es importante que leamos los artículos de Berglundh y de Abrahamsson (2003, 2004) y comprobemos como una macrogeometria poco “agresiva” promueve una reacción de remodelación postquirúrgica limitada.
– La mayoría de las superficies disponibles del mercado consiguen osteointegrarse aunque no obtengan una correcta estabilidad primaria (Rodrigo 2010).
– Algunas supercicies han demonstrado ser más complicadas en el tratamiento de la periimplantitis ,respondiendo poco al tratamiento aplicado (Albouy 2011, Mellado-Valero 2013).
Espero que el artículo haya sido de utilidad y podeis dejar vuestro comentario más abajo o bien al email periospot@periospot.com.